柏金遜症在全球的發病率令人心驚。這種對中樞神經系統造成災難性破壞的神經退行性疾病,普遍影響百分之一的60歲以上人口,甚至年輕人亦未能倖免──知名演員米高霍士(Michael J Fox)確診時僅29歲。現時全球約有一千萬名患者,隨著全球人口預期壽命持續上升,研究人員估計,患者人數到2050年時至少會翻倍。
眾所周知,柏金遜症是一種無法逆轉的疾病。由出現震顫、步態不穩等運動能力喪失症狀開始,逐步演變為一系列複雜病徵包括抑鬱、情緒波動、衝動控制障礙、失去嗅覺,甚至出現幻覺和精神錯亂等。現時僅能靠藥物暫時緩解症狀,但無法阻止病情惡化。若沒有新治療方法,患者將難逃身體衰退的厄運。
不只是緩解
研究人員意識到,僅僅緩解症狀遠遠不足,真正的突破在於「治本」,需要能夠延緩甚至阻斷神經退化進程的疾病修飾療法。香港中文大學(中大)研究團隊研發出新型基因療法。此技術核心在於將一種特殊的肽直接注射到大腦內。在小鼠實驗中已展現顯著療效,只需單次注射,即可緩減病徵及腦退化病變,並改善患者症狀。

領導研究團隊的中大生命科學學院陳文博教授指出,柏金遜症本身極其複雜且成因不明,研發該疾病的治療方法一直困難重重。
「柏金遜症是一種複雜的神經退化病,既有遺傳因素,也受環境影響。儘管科學界對其認識有所增加,但確切成因仍未明朗,使我們難以開發針對性的標靶治療方法。此外,血腦屏障阻礙藥物進入受影響腦區,亦是一大難題。」血腦屏障是大腦的保護盾,會阻擋化學物質、有害藥物及大部分細菌入侵腦部,同時也將治療藥物拒之門外。
雖然柏金遜症的病因尚未完全明確,但普遍認為它與α-突觸核蛋白(α-synuclein)的異常聚集有關。這種蛋白參與神經傳導物釋放,會以多種形狀和結構出現,其中部分異常形態會導致柏金遜症及其他腦退化病變,並在腦內形成稱為路易氏體(Lewy bodies)的堆積。不幸的是,由於α-突觸核蛋白的結構無序,且其聚集過程中的路徑變化莫測,過去一直難以開發針對α-突觸核蛋白的有效療法。
團隊過往曾經研發出一種由SUMO1蛋白衍生的小分子肽,它與泛素(ubiquitin)類似,皆是普遍存在於生物細胞中的小蛋白,具有調控蛋白降解的功能。這種肽獨具特性:可與α-突觸核蛋白結合,阻止其聚集;而且它本身來自人體,被免疫系統排斥的機會亦較低。
衝破血腦屏障
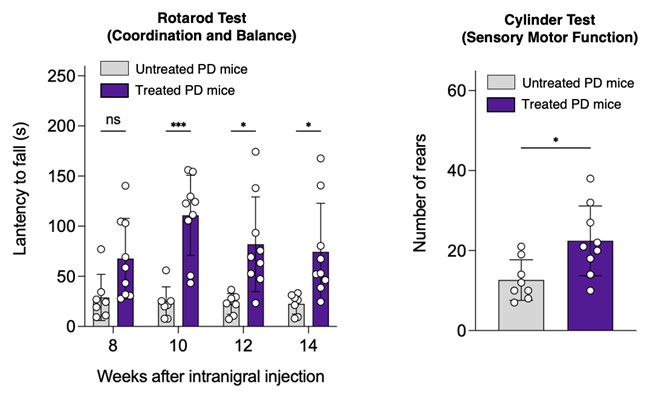
為了越過血腦屏障,這種肽借助重組腺相關病毒(rAAV)為載體,直接注射入大腦。rAAV是一種剔除了病毒脱氧核糖核酸(DNA)的病毒,常用於運載基因治療藥物至體內各處。動物實驗顯示該肽能夠防止α-突觸核蛋白積聚,並保護腦內神經細胞,明顯改善了小鼠們的柏金遜症狀,使牠們能在勻速轉棒實驗中保持平衡更久。
實驗針對的目標腦區為黑質(substantia nigra),是運動控制的關鍵。陳教授解釋:「精確鎖定這一區域,有望增強該肽對α-突觸核蛋白積聚及神經元流失的防護作用,同時減少脫靶風險,令治療更安全。」
「SUMO1與目標蛋白融合後,已證實能提升蛋白溶解度並防止聚集,原本我們打算利用自家開發的定點技術將SUMO1與α-突觸核蛋白融合,卻意外發現即使不融合,SUMO1本身也可直接防止α-突觸核蛋白聚集。」
更令人鼓舞的是,透過rAAV遞送的肽療法,療效可維持十年以上。有利用靈長類進行的柏金遜症研究,更顯示藥效可持續長達十五年。這將大幅減少患者需要注射的次數,降低風險及成本。
邁向臨床應用
為推動研究成果轉化為臨床應用,團隊已於2025年1月成立SUMO Therapeutics公司。除了針對柏金遜症,他們的研究成果對同樣由異常蛋白積聚導致的退化性疾病也具應用潛力,如路易氏體失智症等。
陳教授說:「我們已證實這些肽能有效改善小鼠的運動障礙,並保護神經元免於退化。這是令人非常鼓舞的重大進展,為未來開展人體臨床試驗奠定基礎。」
接下來,團隊將繼續改進rAAV載體,以提升肽療法在人類治療中的效果,並計劃在猴子等其他動物模型驗證肽的功效。雖然項目距離商業化仍有數年之遙,團隊現正積極尋求學術界和業界資助,以裝備更強力的武器對抗柏金遜症。